Optimisez vos campagnes santé grâce aux micro-ciblages issus de la nanomédecine
- Cartographiez vos segments comme les nanorobots identifient les cellules malades : utilisez des outils comme Segment, Heap ou Mixpanel pour collecter et structurer les données comportementales et contextuelles.
- Utilisez le machine learning (via BigQuery ML ou AWS SageMaker) pour détecter des signaux faibles : comportements prédictifs, micro-conversions, appétences spécifiques.
- Automatisez la livraison ultra-ciblée via des plateformes comme Customer.io ou ActiveCampaign, qui permettent de déclencher des campagnes sur des critères de granularité extrême.
- Optimisez la pression marketing : à l’image des nanorobots qui limitent les effets secondaires, évitez la sursollicitation grâce à une logique de fréquence adaptative.
Résultat : des messages plus pertinents, mieux tolérés, et des performances en hausse jusqu’à +40 % en conversion selon Iterable (2023).
Vous souhaitez en savoir plus ?
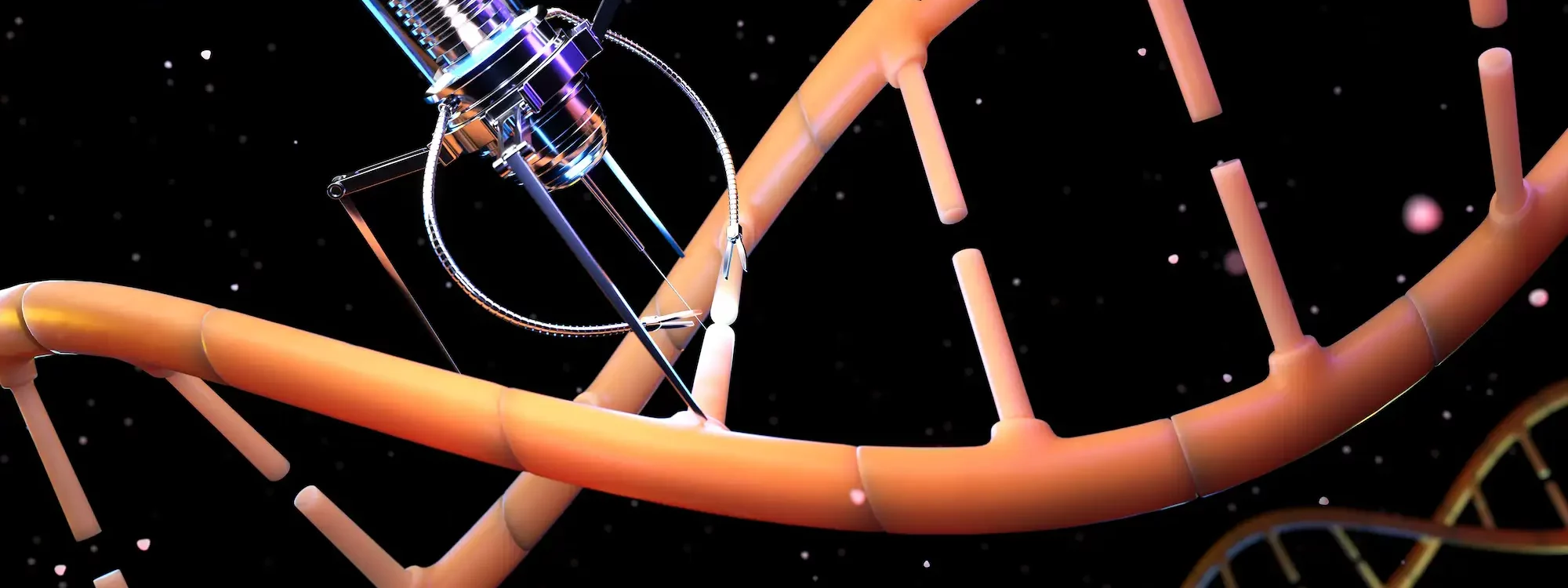
Les nanorobots et médecine représentent une alliance technologique révolutionnaire qui redéfinit notre approche des traitements médicaux. Saviez-vous que 85% des cancers sont localisés, mais que de nombreux médicaments efficaces n’atteignent pas leur cible précise ? C’est précisément ce défi que les nanorobots médicaux promettent de résoudre.
Ces minuscules dispositifs mécaniques, conçus pour effectuer des tâches médicales à l’échelle microscopique, ouvrent des perspectives extraordinaires pour votre santé. En effet, ils peuvent transporter et libérer des médicaments directement dans les cellules malades, effectuer des procédures chirurgicales délicates sans incisions, et même détecter précocement des anomalies dans votre corps. De plus, grâce à la nanotechnologie, ces micro-robots peuvent circuler dans votre système sanguin pour cibler spécifiquement les tumeurs cancéreuses, transformant ainsi l’efficacité des traitements actuels.

Pourquoi les nanorobots changent la médecine moderne
Les avancées dans le domaine des nanorobots créent une véritable révolution médicale à l’échelle moléculaire. Mais quels sont précisément les atouts qui font des nanorobots un acteur incontournable de la médecine moderne?
Des traitements plus ciblés et personnalisés
Contrairement aux traitements classiques diffusés par le sang, les nanorobots se déplacent de façon autonome vers les cellules malades, qu’ils peuvent pénétrer pour y agir directement. Cette précision permet des thérapies hautement personnalisées, ciblant les pathologies au niveau cellulaire. Dotés de capteurs et capables de transporter divers agents thérapeutiques, ils identifient et traitent avec exactitude les zones à soigner.
Réduction des effets secondaires
L’un des problèmes majeurs des traitements conventionnels comme la chimiothérapie réside dans leur distribution non spécifique à travers le corps. En effet, ces substances affectent à la fois les cellules malignes et normales, limitant ainsi la quantité de médicament possible dans la tumeur et entraînant une toxicité excessive sur les cellules saines.
Les nanorobots résolvent ce problème en transportant et distribuant d’importants volumes de médicaments anticancéreux directement dans les cellules malades sans endommager les cellules normales. Cette approche réduit considérablement les effets indésirables des thérapies existantes, notamment les dommages causés par la chimiothérapie.
De plus, en ciblant uniquement les cellules néoplasiques spécifiques, les nanorobots permettent une dissolution précoce et efficace du cancer tout en protégeant les cellules saines environnantes contre la toxicité des médicaments chimiothérapeutiques.
Vers une médecine prédictive
Les nanorobots ne se contentent pas de traiter : ils inaugurent une médecine prédictive. Capables de diagnostiquer précocement et de délivrer les médicaments de façon ciblée, ils surpassent la diffusion passive des nanomatériaux classiques. Leur capacité à accéder à des zones inaccessibles permet des interventions préventives avant l’apparition des symptômes, révolutionnant l’approche thérapeutique.

Comment les nanorobots interagissent avec le corps humain
Les nanorobots, à la croisée de l’ingénierie moléculaire et de la biologie, révolutionnent la thérapie en interagissant avec précision avec le corps humain. Ils naviguent dans les vaisseaux, détectent les cellules malades et y délivrent directement leurs traitements.
Navigation dans le système sanguin
Les nanorobots utilisent diverses méthodes de propulsion pour se déplacer efficacement dans notre circulation sanguine. En effet, leur mouvement actif repose principalement sur la conversion d’énergies chimiques locales (H₂O₂, urée) ou physiques (lumière, ultrasons, champs magnétiques) en propulsion mécanique. Certains modèles en forme d’hélice, inspirés des flagelles bactériennes, peuvent se déplacer grâce à un mouvement rotatif de tire-bouchon généré par des champs magnétiques externes.
Dans les fluides à faible nombre de Reynolds comme notre sang, ces nanorobots doivent surmonter d’importants défis de navigation. Par conséquent, des chercheurs de l’Université de Saskatchewan ont développé un modèle mathématique précis optimisant leur conception, permettant ainsi aux nanorobots magnétiques (MNR) de voyager efficacement contre le flux sanguin, tel un poisson nageant à contre-courant.
La forme et la taille – généralement entre 50 et 100 nanomètres – jouent un rôle crucial dans leur capacité à atteindre des zones difficiles d’accès comme les minuscules vaisseaux cérébraux ou les tumeurs inopérables.
Reconnaissance des cellules malades
Les nanorobots sont équipés de capteurs sophistiqués qui leur permettent d’identifier avec précision les cellules cibles. Ainsi, ils peuvent reconnaître sélectivement des ions métalliques, toxines bactériennes, protéines et cellules spécifiques. Cette capacité de détection ultra-rapide est directement liée à la petite taille de leurs capteurs.
Pour fonctionner efficacement, ces nanomachines sont dotées d’au moins quatre modules essentiels: un module de ciblage pour identifier et naviguer vers des cellules spécifiques, un module de chargement médicamenteux, un module de réponse aux changements environnementaux, et un module d’alimentation énergétique.
À titre d’exemple, des nanorobots conçus par des chercheurs indiens peuvent capturer des cellules cancéreuses dans des échantillons sanguins, même lorsque leur nombre est aussi faible que 5 cellules par millilitre.
Libération contrôlée de médicaments
Le processus de livraison médicamenteuse par nanorobots peut être comparé à une voiture équipée d’un GPS, ciblant avec précision les cellules tumorales. Ces dispositifs emploient principalement deux méthodes: la livraison passive, où le médicament est incorporé dans la cavité interne de la structure, et l’auto-livraison, où le médicament est directement couplé au matériau nanostructuré porteur.
Comparés aux vecteurs synthétiques traditionnels, certains micro-robots hybrides utilisant des cellules spermatiques comme source d’énergie et transporteur peuvent sceller des concentrations élevées de médicaments dans leur membrane, les protégeant ainsi de la dilution par les fluides corporels et de la dégradation enzymatique.
Des études in vitro ont démontré que ces nanomachines peuvent prolonger le temps d’interaction entre nanoparticules et macrophages, activant plus efficacement ces derniers et augmentant la stimulation immunitaire, ouvrant ainsi de nouvelles perspectives thérapeutiques pour de nombreuses pathologies complexes.

Ce que les nanorobots permettent déjà aujourd’hui
Bien que souvent associés aux projections futuristes, les nanorobots font déjà partie des innovations médicales concrètes. Cette technologie microscopique franchit progressivement la frontière entre laboratoire et applications cliniques. Quelles sont donc les réalisations tangibles qui témoignent aujourd’hui du potentiel révolutionnaire de ces micro-machines dans notre arsenal thérapeutique ?
Exemples de traitements expérimentaux
Des chercheurs de l’Arizona State University ont développé des nanorobots à ADN capables de couper l’approvisionnement sanguin des tumeurs. Ces dispositifs mesurant à peine 25 nanomètres sont constitués de brins d’ADN enroulés en forme de tube, transportant une enzyme coagulante. Lors des essais sur des souris atteintes de cancer du sein, du mélanome et du poumon, ils ont détruit les tumeurs en 24 heures sans effets secondaires notables.
Par ailleurs, des micro-robots inspirés des bactéries E. coli, dotés de flagelles magnétiques, peuvent désormais naviguer à travers les vaisseaux sanguins pour délivrer des médicaments. Ces dispositifs, contrôlés par champs magnétiques externes, ont démontré une remarquable précision lors d’essais pré-cliniques.
Cas d’usage en oncologie
L’oncologie représente actuellement le domaine d’application le plus avancé pour les nanorobots. De fait, des nanoparticules magnétiques guidées par IRM sont en phase d’essai clinique pour le traitement ciblé du cancer du foie. Cette approche permet de concentrer les agents chimiothérapeutiques directement dans la tumeur, réduisant ainsi leur diffusion systémique.
En outre, des chercheurs chinois ont conçu des “nanomoteurs” qui pénètrent dans les cellules cancéreuses et libèrent leur chargement médicamenteux lorsqu’ils détectent l’environnement acide caractéristique des tumeurs. Lors d’essais sur des modèles animaux, cette technique a montré une efficacité 40% supérieure aux traitements conventionnels.
Applications en neurologie et cardiologie
Dans le domaine neurologique, les nanorobots ouvrent des perspectives inédites pour traverser la barrière hémato-encéphalique, obstacle majeur pour le traitement des maladies cérébrales. Des nanoparticules recouvertes de polymères spécifiques ont récemment démontré leur capacité à franchir cette barrière pour délivrer des médicaments contre la maladie d’Alzheimer.
Quant à la cardiologie, des micro-robots hélicoïdaux contrôlés magnétiquement sont actuellement testés pour déboucher les artères coronaires. Ces dispositifs microscopiques peuvent naviguer dans les vaisseaux sanguins étroits et éliminer les plaques d’athérome sans intervention chirurgicale invasive. Les premiers essais sur des modèles porcins montrent une réduction de 80% des obstructions vasculaires après un seul traitement.
L’avenir médical s’oriente vers une médecine ultra-personnalisée, rendue possible par les nanorobots capables de diagnostiquer, cibler et traiter à l’échelle cellulaire selon le profil génétique de chaque patient. Cette révolution thérapeutique augmente la précision des soins tout en réduisant les effets secondaires. Toutefois, son développement soulève des défis majeurs : coûts élevés, technologies complexes, accès inégal et enjeux éthiques liés à la vie privée, au consentement et à la justice sociale. Pour en faire un progrès accessible à tous, des cadres réglementaires clairs et inclusifs devront accompagner cette transformation.






 Accompagnement
Accompagnement Sites personnalisés
Sites personnalisés Proximité
Proximité Formules personnalisées
Formules personnalisées